Sección de Química Orgánica
Departamento de Química Inorgánica y Orgánica
Investigación
Líneas de Investigación
Grupo
Vínculos
- Catálisis
Formación estereoselectiva de enlaces carbono-carbono a partir de enolatos generados catalíticamente con complejos de níquel(II)
Estamos interesados en el desarrollo de nuevos métodos de síntesis asimétrica basados en la activación de complejos metálicos, estructuralmente sencillos y fáciles de manipular, en el propio medio de reacción. Las especies resultantes pueden catalizar la formación de enolatos de N-acil tioimidas que, a continuación, participan en la construcción estereoselectiva de enlaces carbono-carbono. Se trata, en definitiva, de reacciones directas a partir de N-acil tioimidas.
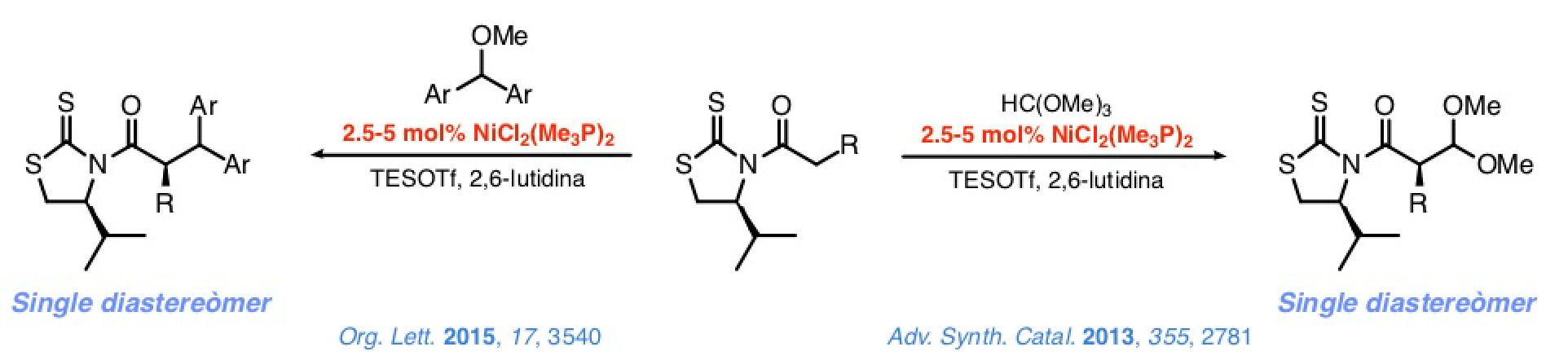
Una serie de estudios sobre la adición de N-acil-4-isopropil-1,3-tiazolidin-2-tionas a ortoformiato de metilo o diarilmetil metil éteres en presencia de cantidades subestequiométricas de complejos de níquel(II) estructuralmente sencillos y comercialmente asequibles, (R3P)2NiCl2, confirmaron la verosimilitud de nuestra aproximación.
Así, la reacción de estos complejos con TESOTf incrementa notablemente la electrofília del metal y facilita la enolización de las N-acil tioimidas. Paralelamente, el TESOTf transforma los electrófilos antes mencionados en intermedios carbénicos u oxocarbénicos que reaccionan con los enolatos de níquel(II) de acuerdo con un mecanismo de tipo SN1.El control sobre la configuración del estereocentro en α es excelente.
El control sobre la configuración de la posición β es más limitado, pero la adición de la N-azidoacetil tioimida a dialquilacetales aromáticos o propargílicos cobaltados conduce a los correspodientes aductos de configuración 2,3-anti con un control estereoquímico excelente. La síntesis de tripéptidos que contienen la β-hidroxitirosina en la posición central puede completarse fácilmente utilizando esta metodología.
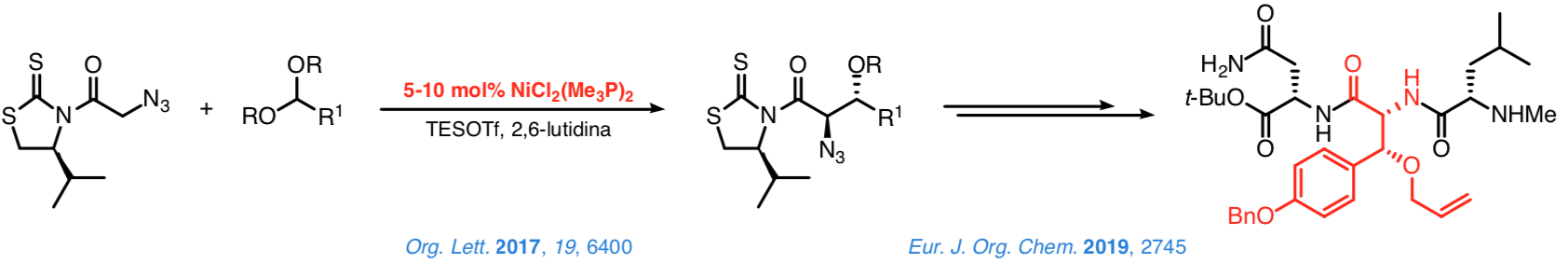
Estamos especialmente interesados en desarrollar una metodología general más eficaz mediante el uso de catalizadores quirales que permitan un control efectivo de la configuración de los nuevos estereocentros. En este sentido, hemos demostrado que las N-acil-1,3-tiazinan-2-tionas son plataformas idóneas a partir de las cuales se pueden llevar a cabo reacciones directas y enantioselectivas catalizadas por [DTBM-SEGPHOS]NiCl2.
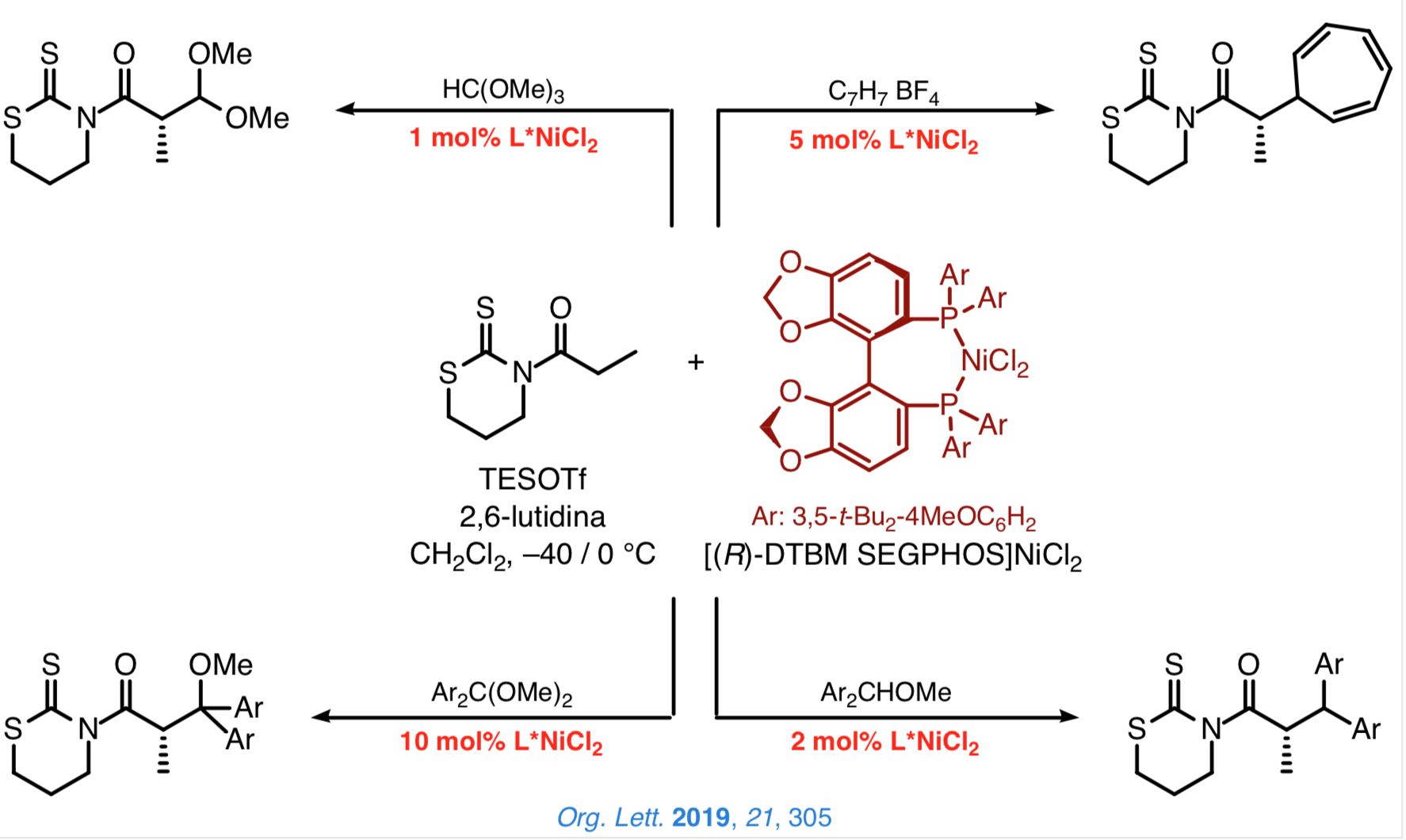
Actualmente estamos evaluando nuevos procesos de construcción directa y enantioselectiva de enlaces carbono-carbono catalizados por complejos de níquel(II) quirales que implican la generación simultánea de dos nuevos estereocentros.
- Enolatos de titani como birradicales
Formación estereoselectiva de enlaces carbono-carbono y carbono-oxígeno mediante la reacción con radicales
|
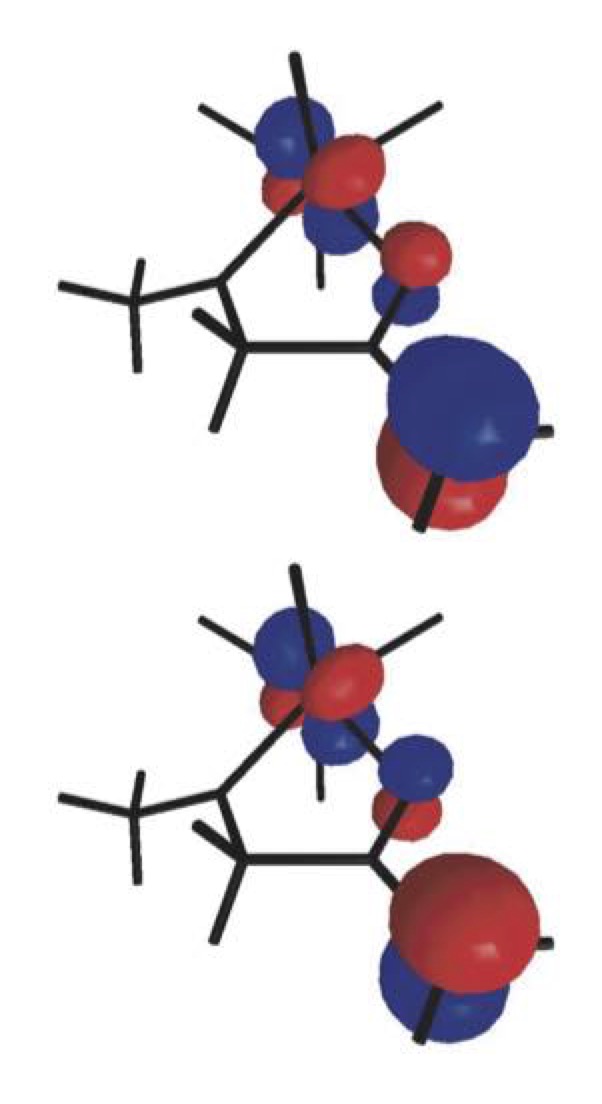
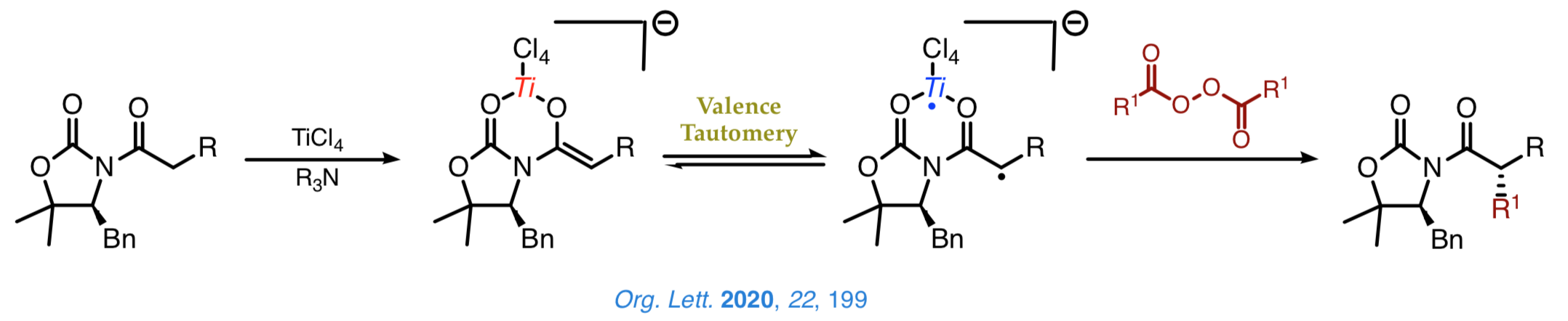
El descubrimiento unos años atrás del carácter birradicalario de los enolatos de titanio(IV) de α-hidroxi cetonas abrió un nuevo campo de estudio dedicado a la comprensión de esta sorprendente característica y al aprovechamiento de la nueva reactividad radicalaria que de ella se deriva. Así, habiendo demostrado que el carácter birradicalario de estos enolatos se basa en una tautomería de valencia cuyo origen se encuentra en la variación de la distancia Ti–O, nos proponemos desarrollar nuevos métodos de formación estereoselectiva de enlaces carbono-carbono y carbono-oxígeno a partir de radicales y enolatos de titani quirales. |

|
|
Los estudios llevados a cabo han establecido que las oxazolidinonas o las oxazoldintionas quirales son idóneaas para la formación estereoselectiva de enlaces carbono-oxígen con TEMPO y oxígeno molecular sin necesidad de añadir ningún otro aditivo, tal y como se muestra a continuación.
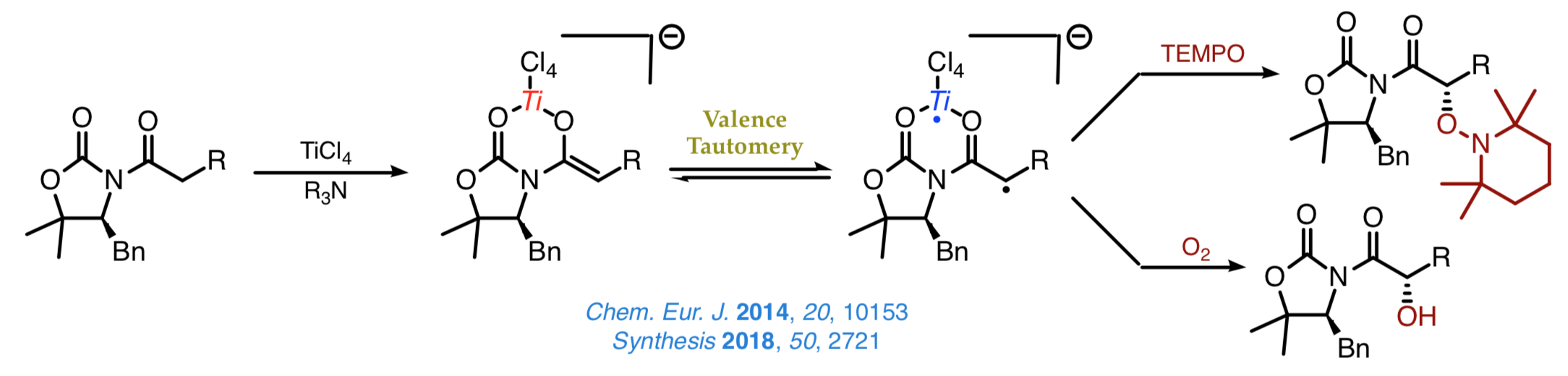
Actualmente estamos explorando nuevas aproximaciones de naturaleza radicalaria a la formación estereoselectiva de enlaces carbono–carbono que permitan la incorporación de grupos que son difíciles de introducir mediante otros métodos. Un ejemplo de estas transformaciones lo constituye la alquilación descarboxilativa que se muestra a continuació, la cual alcanza elevadas cotas de quimioselectivitat y un magnífico control estereoquímico sobre la configuració del centro Cα.
- Enolatos de titanio como nucleòfilos
Formación estereoselectiva de enlaces carbono-carbono: adiciones aldólicas y de Michael
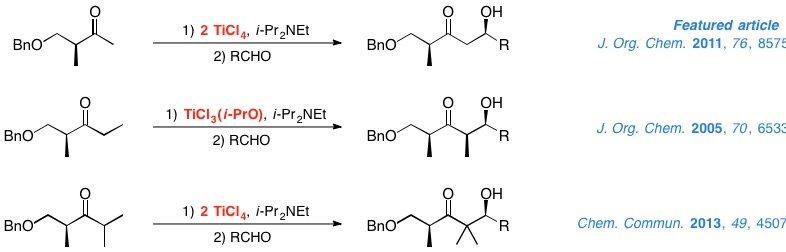
Durante los últimos años, las cetonas quirales se han revelado como substratos muy eficaces para la construcción estereoselectiva de enlaces carbono-carbono. En particular, nuestro grupo ha estudiado exhaustivamente las reacciones aldólicas de los enolatos de titanio de α- y β-hidroxi cetonas quirales. Así, hemos demostrado la tremenda influencia que los grupos protectores y los ácidos de Lewis de titanio tienen sobre la configuración de los aldoles resultantes. Por otro lado, hemos desarrollado sendas metodologías que proporcionan excelentes resultados en la reacciones aldólicas de metil, etil e isopropil cetonas derivadas del éster de Roche.

|
|
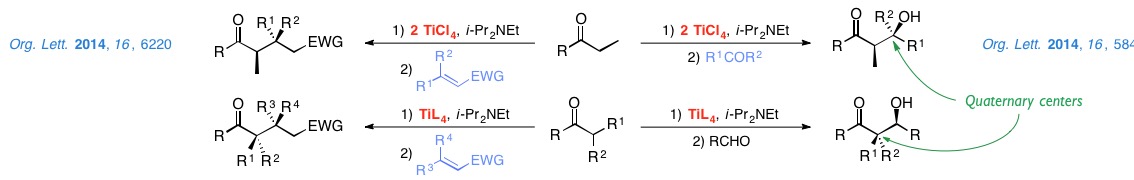
Actualmente, estamos estudiando procesos de tipo aldólico que permitan la construcción estereoselectiva de centros cuaternarios y las adiciones Michael a enonas y nitroalquenos.
- Síntesis de Compuestos Biológicament Activos
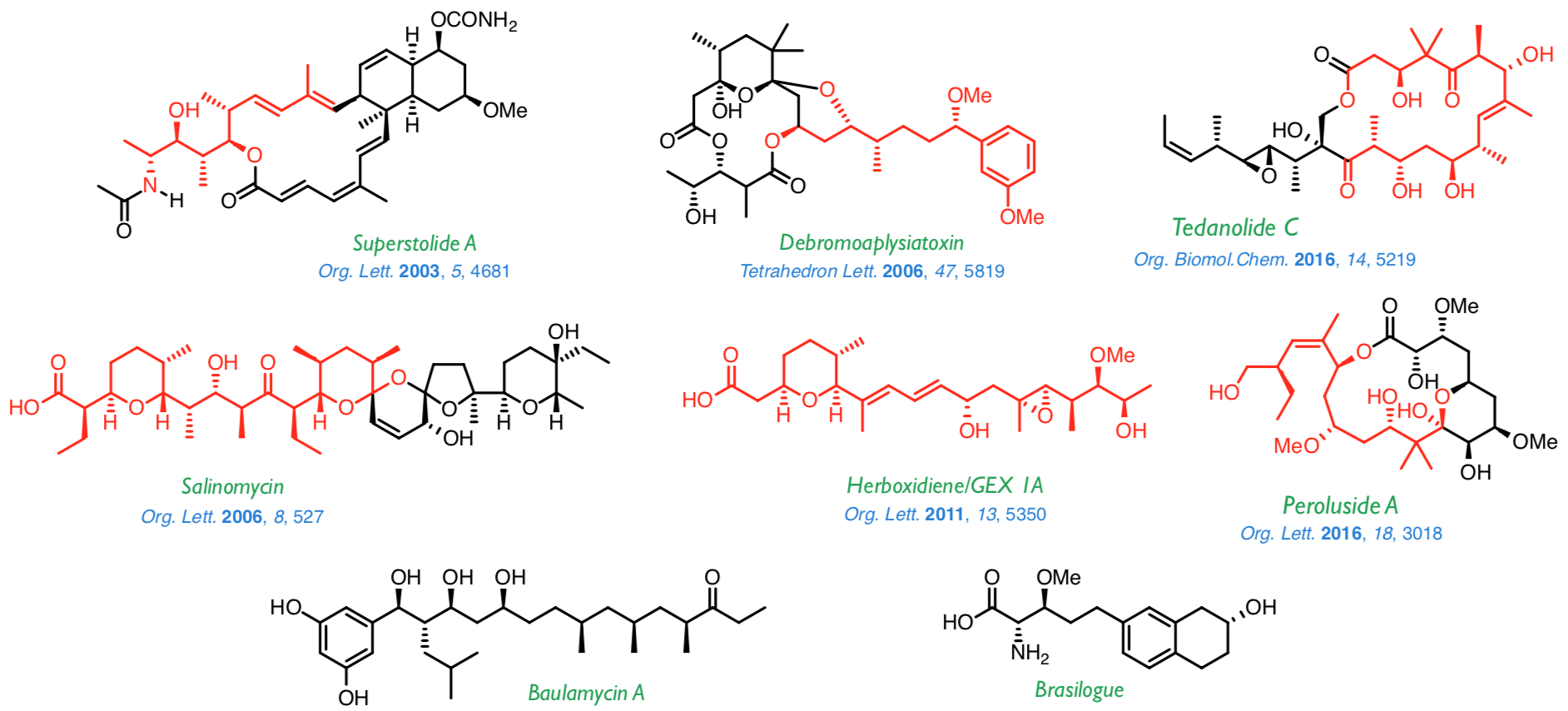
Aplicación de les metodologías anteriores a la síntesis de productos naturales
Las metodologías descritas en les líneas anteriores se han aplicado satisfactoriamente a la síntesis de un amplio abanico de productos naturales como los que se muestran a continuación. Actualmente estamos interesados en la síntesis de la baulomicina A y el brasilogue.